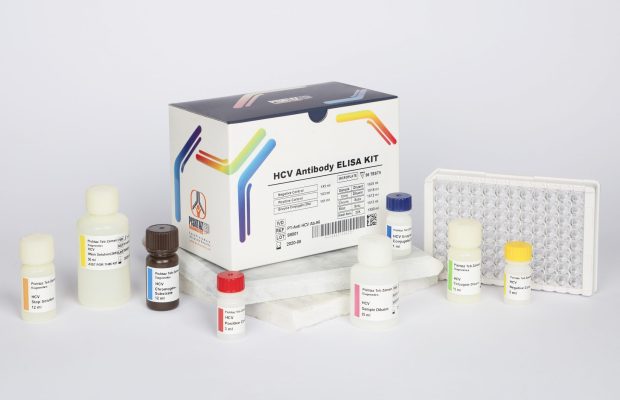
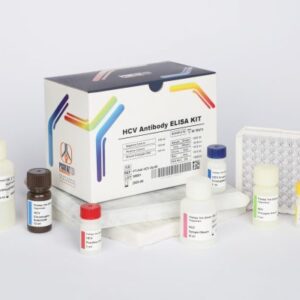
کیت الایزای HCV Ab
آنزیم ایمونواسی براي تشخیص آنتی بادي ویروس هپاتیت C) تنها براي استفاده در تشخیص آزمایشگاهی)
ویروس هپاتیت C) HCV (که در سال 1989 شناخته شد از خانواده فلاوي ویریده بوده و عامل هپاتیت منتقل شونده از طریق انتقال خون است
کیت سنجش HCV -Anti به روش الایزا
آنزیم ایمونواسی براي تشخیص آنتی بادي ویروس هپاتیت C) تنها براي استفاده در تشخیص آزمایشگاهی)
مقدمه :
ویروس هپاتیت C) HCV (که در سال 1989 شناخته شد از خانواده فلاوي ویریده بوده و عامل هپاتیت منتقل شونده از طریق انتقال خون است. قبل از کشف این
ویروس، عامل ایجاد کننده این نوع هپاتیت را nonB-nonA می نامیدند. ژنوم این ویروس شامل یک RNA تک رشته اي با حدود 10000 نوکلئوتید به همراه یک
کپسید، یک ماتریکس و یک غلاف می باشد. این ویروس کد کننده یک پیشساز پلی پروتئینی است که به 3 بخش ساختمانی 2E 1,E, Core و -6 4 بخش غیر
ساختاري پروتئینی5NS , 4NS , 3NS , 2NS 1,NS تقسیم میشود. از لحاظ ژنتیکی ویروس هپاتیت C به شش ژنوتیپ اصلی (ماژور) و حداقل 80 زیر گونه تقسیم
میشود. مطابق مطالعات انجام شده ژنوتیپهاي شایع در ایران به ترتیب a1 و a3 و b1 و 4 بوده و میزان ابتلا به این عفونت در ایران در حدود %1 جمعیت می باشد .
انتقال این ویروس از راه خون و محصولات آن و سرنگ آلوده میباشد ، همچنین احتمال آلودگی بوسیله وسایل آلوده که در خالکوبی و یا سوراخ کردن گوش و یا ختنه
و دستگاه هاي همودیالیز استفاده می شوند، وجود دارد. قبل از آنکه عملیات غربالگري در مورد این ویروس انجام گیرد حدود %90 هپاتیتهاي بعد از انتقال خون بوسیله
این ویروس بوجود می آمد. انتقال از مادر به فرزند و یا از طریق جنسی بسیار محدود است. بیشتر افرادي که به عفونت حاد HCV مبتلا هستند بدون علامت بوده و یا
داراي علائم خفیفی همچون احساس خستگی، تهوع و زردي می باشند. دوره نهفته بیماري قبل از بروز اولین علائم بین 15 تا 150روز است. در حدود %80 موارد این
بیماري مزمن می شود که از این میزان 20 – 15 % به سیروز می انجامد و از این مقدار -4 1 % مبتلا به سرطان کبد می گردند. جدا سازي آنتی بادي اختصاصی
تولید شده علیه آنتی ژنهاي اختصاصی این ویروس در شناسایی افراد آلوده بسیار حائز اهمیت است. از میان روشهایی که امروزه براي تشخیص این بیماري کاربرد دارند
blot Western مجدداً آزمایش شده و بررسی گردند. کیت حاضر از نسل سوم الایزا با حساسیت و اختصاصیت بالا بوده و قابلیت اندازه گیري آنتی بادي اختصاصی ، روش الایزا از حساسیت بالایی برخوردار بوده و جهت بررسی اولیه و آزمایش غربالگري از آن استفاده می شود. نمونه هاي مثبت با این روش، بایستی با روش تاییدي
علیه HCV را دارا می باشد .
اساس آزمایش :
اساس آزمایش در این کیت بر روش Immunoassay Enzyme Indirect استوار است. چاهکهاي پلیت با آنتی ژنهاي نوترکیب CORE , 5NS , 4NS , 3NS
مربوط به HCV پوشش داده شده اند، در هنگام آزمایش ، پس از افزودن سرم، در صورت وجود آنتی بادیهاي اختصاصی علیه HCV) IgG-IgM (آنتی بادیها از طریق
Fab به آنتی ژنهاي کف چاهک متصل می شوند. پس از انکوباسیون و شستشو، محلول آنزیم کونژوگه که حاوي آنتی هیومن آنتی بادي نشاندار شده با آنزیم HRP
می باشد به چاهکها اضا فه می شود. آنتی هیومن آنتی بادي کونژوگه به صورت اختصاصی به قسمت Fc آنتی بادیهاي متصل شده به آنتی ژنهاي کف چاهک اتصال
یافته و ایجاد کمپلکس می نماید. پس از انکوباسیون و شستشو، محلول سوبسترا و کروموژن به چاهکها اضافه می شود. رنگ آبی ایجاد شده بعد از این مرحله نتیجه
تجزیه سوبسترا در اثر فعالیت آنزیم و تغییر رنگ محلول کروموژن ناشی از این واکنش است. شدت این رنگ متناسب با تعداد کمپلکسهاي ایمنی ایجاد شده در
چاهکها می باشد . با افزودن محلول متوقف کننده، رنگ آبی به زرد تبدیل می شود که بهترین جذب نوري را در طول موج 450 نانومتر دارد .
محتویات کیت :
1) پلیت 96 خانه حاوي چاهکهاي پوشش داده شده با آنتی ژنهاي اختصاصی HCV .
2) محلول آنزیم کونژوگه (Conjugate Enzyme (: یک ویال حاوي 1 میلی لیتر کونژوگه غلیظ (X 20 (داراي منوکلونال آنتی هیومن IgG و IgM نشاندار شده با
پراکسیداز در محلول بافري حاوي پروتئین و نگهدارنده. این محلول را باید قبل از مصرف، با محلول رقیق کننده کونژوگه به نسبت 1/20 رقیق نمود .
3) محلول رقیق کننده کونژوگه (Diluent Conjugate (: یک ویال حاوي ml 15محلول بافري سبز رنگ، داراي پروتئین به عنوان پایدار کننده و %0/05 کاتن به
عنوان ماده محافظ.
4) محلول رقیق کننده نمونه (Diluent Sample (: یک ویال حاوي ml 25 محلول بافري قرمز رنگ، داراي پروتئین به عنوان پایدار کننده و %0/05 کاتن به عنوان
ماده محافظ و %0/02 توئین، جهت رقیق سازي سرمها .
5)سرم کنترل مثبت (Control Positive (: یک ویال حاوي ml 3 محلول بافري قرمز رنگ، داراي پروتئین به عنوان پایدار کننده و %0/05 کاتن به عنوان ماده
محافظ و سرم انسانی غیر فعال شده، حاوي آنتی بادي علیه HCV .
6) سرم کنترل منفی (Control Negative (: یک ویال حاوي ml 5 محلول زرد رنگ داراي بافر فسفات و %0/05 کاتن به عنوان ماده محافظ و سرم انسانی منفی از
. نظر آنتی باديHCV
7) محلول رنگزاي یک مرحله اي (Substrate-Chromogen (: 1 ویال حاوي 12 میلی لیتر تترا متیل بنزیدین و آب اکسیژنه (آماده براي مصرف) .
8) محلول شستشو : یک ویال حاوي 50 میلی لیتر محلول شستشوي غلیظ (X20 (محتوي محلول بافر فسفات و %0/05 توئین . جهت تهیه محلول شستشوي آماده
مصرف، مقدار مورد نیاز را با آب مقطر به نسبت 1/20 رقیق نمایید .
9) محلول متوقف کننده (Solution Stop (: یک ویال حاوي 12میلی لیتر اسید کلریدریک 1 نرمال .
10) برچسب مخصوص پلیت .
مواد و وسایل مورد نیاز که در کیت موجود نمی باشند :
1) دستگاه الایزاریدر با طول موج 450 نانومتر (و در صورت امکان فیلتر 630 نانومتر به عنوان رفرانس) .
2) سمپلر هاي 10 و 100 و200 میکرولیتر دقیق .
3) بن ماري یا انکوباتور 37 درجه سانتی گراد .
4) محلول هیپوکلریت سدیم %5 یا محلول ضد عفونی کننده دیگر .
5) آب مقطر .
نکات قابل ذکر براي مصرف کنندگان :
1) محتویات این کیت تنها براي مصرف در همین کیت قابل استفاده هستند .
2) این کیت صرفا جهت اندازه گیري HCV-Anti در سرم و پلاسماي انسانی طراحی و ساخته شده است .
3) از مخلوط کردن محتویات کیتها با شماره ساختهاي مختلف جداً خودداري نمایید .
4) کلیه مواد موجود در کیت که منشاء سرمی دارند از نظر وجود Ag.HBs و آنتی بادیهاي ضد HIV کنترل گردیده و فاقد این عوامل میباشند (کنترل مثبت کیت
حاوي آنتی بادیهاي HCV و از نظرآنتی ژن HCV غیر فعال شده است. غیر فعال سازي سرم یا پلاسما بمدت نیم ساعت در 56 درجه سانتی گراد انجام گرفته است).
جهت احتیاط بهتر است کاربرانی که با کیت کار می کنند از تماس مستقیم با مواد بپرهیزند .
5) هنگام انجام آزمایش حتماً از دستکشهاي یکبار مصرف استفاده کنید . همچنین استفاده از عینکهاي آزمایشگاهی هنگام کار با سرمهاي بیماران توصیه می شود .
6) سرمهاي مثبت از نظر آنتی بادیهاي ضد HCV ، وسایل و محلولهاي wash مشکوك به آلودگی را بعد از اتمام کار به مدت حداقل 30 دقیقه در مجاورت محلول
هیپوکلریت سدیم %5 یا محلولهاي مناسب ضد عفونی کننده دیگر قرار دهید . همچنین اتوکلاو ، به مدت 20 دقیقه در 121 درجه سانتی گراد پیشنهاد می گردد .
هشدار هاي توصیه اي:
از این کیت فقط در مقاصد تشخیصی استفاده شود. این کیت براي مقاصد غربالگري تولید نشده است .
شرایط نگهداري :
1) کیت را در یخچال بین دماي 2 تا 8 درجه سانتی گراد نگهداري نمایید .
2) چاهکها را در کیسه مخصوص پلیت همراه با نمگیر نگهداري نمایید. پایداري پلیت بعد از باز کردن کیسه آن 4 ماه میباشد .
3) پایداري محتویات کیت (قبل از باز شدن درب کیت) تا پایان مدت انقضاء یاد شده بر روي هر یک از آنها می باشد .
4) محلول شستشو را به نسبت 1/20 با آب مقطر رقیق نمایید. این محلول (آماده مصرف) به مدت یک هفته در شرایط 8 – 2 درجه سانتیگراد قابل نگهداري و مصرف
می باشد.
جمع آوري و آماده سازي نمونه :
سرم و یا پلاسماي داراي EDTA را می توان پس از جدا نمودن از سلولهاي خون استفاده نمود، اما از سرم یا پلاسماي رقیق شده یا Pooled با نمونه هاي دیگر نباید
استفاده کرد . نمونه را می توان به مدت یک هفته در دماي 2 تا 8 درجه سانتی گراد و یا براي مدت زمان طولانی تر در دماي -20 درجه سانتی گراد نگهداري نمود
(در ضمن باید از thaw-Freeze نمودن نمونه پرهیز شود) . از نمونه هاي مشکوك به آلودگی میکروبی جهت انجام آزمایش استفاده نشود .
توضیحات عمومی :
1) قبل از شروع مراحل آزمایش تمام مواد و نمونه ها را به درجه حرارت اتاق برسانید. جهت ماندگاري بهتر پلیت ، آن را مانند سایر اجزاء کیت، بعد از رسیدن به دماي
محیط از کیسه مخصوص آن خارج کرده و چاهکهاي مورد نیاز را بردارید .
2) بهتر است به محض شروع آزمایش کلیه مراحل بدون توقف انجام پذیرند .
3) از نوك سمپلر یک بار مصرف براي هر نمونه استفاده کنید .
4) پس از افزودن محلول متوقف کننده، جذب نوري چاهکها حداکثر تا نیم ساعت قابل قرائت می باشد .
5) براي کسب نتایج مطلوب باید شستشوي چاهکها بصورت کامل صورت گرفته و آخرین قطرات پس از شستشو از چاهکها تخلیه شوند .
6) از مهمترین فاکتورها در حصول نتیجه مطلوب ، زمان مناسب انکوباسیون می باشد، بنابراین پیشنهاد می گردد قبل از شروع آزمایش تمام مواد و محلولهاي مورد نیاز
را آماده نموده و درب محلولهاي مورد نیاز را باز کنید، این عمل با کاهش فاصله زمانی بین مراحل سمپلینگ باعث نتایج مطلوب تري می شود .
تهیه محلول کونژوگه آماده مصرف :
بر اساس جدول زیر و بر حسب نیاز، کونژوگه غلیظ را با محلول رقیق کننده کونژوگه به نسبت 1/20رقیق نموده و به آرامی مخلوط کنید .
تعداد استریپها 1 2 3 4 5 6 7 8 9 10 11 12
حجم رقیق کننده کونژوگه ml 0/95 1/9 2/85 3/8 4/75 5/7 6/65 7/6 8/55 9/5 10/45 11/4
حجم کونژوگه غلیظ ml 0/05 0/1 0/15 0/2 0/25 0/3 0/35 0/4 0/45 0/5 0/55 0/6
مراحل انجام آزمایش :
1) تعداد چاهکهاي مورد نظر را انتخاب نموده و سایر چاهکها را به همراه نمگیر درون کیسه مخصوص نگهداري پلیت قرار داده و درب آن را ببندید. چاهک اول را به
عنوان بلانک انتخاب نموده و در ادامه دو چاهک براي کنترل منفی و یک چاهک براي کنترل مثبت در نظر بگیرید .
2) 200 میکرولیتر از سرم کنترل مثبت و200 میکرولیتر از سرم کنترل منفی را به چاهکهاي مورد نظر اضافه نمایید .
3) 200 میکرولیتر محلول رقیق کننده نمونه (Diluent Sample (را به همه چاهکها بجز چاهکهاي بلانک ، کنترل مثبت و کنترل منفی اضافه نمایید .
4) 10 میکرولیتر از سرمها را به چاهکهاي مورد نظر اضافه نمایید .
5) چاهکها را به مدت 15 ثانیه به ملایمت تکان دهید و درب چاهکها را با برچسب مخصوص پلیت پوشانده و سپس به مدت 60 دقیقه در 37 درجه سانتی گراد انکوبه
نمایید .
6) محتویات چاهکها را خالی کرده و چاهکها را 5 بار با محلول شستشوي آماده مصرف بشویید (براي شستشو چنانچه دستگاه شستشوي اتوماتیک در دسترس نباشد
آزمایش گردد . در هر دفعه شستشو حدود 300 میکرولیتر محلول شستشو در هر چاهک ریخته و سپس چاهک ها را با وارونه کردن و تکاندن خالی نمایید و در انتهاي می توان از سمپلر 8 کاناله استفاده نمود ولی باید مواظب بود که محلول شستشو از یک چاهک به چاهک دیگر وارد نشود زیرا می تواند موجب ایجاد خطا در نتیجه
عملیات شستشو چاهکها را در حالت وارونه و با ضربات ملایم بر روي یک پارچه یا کاغذ نمگیر بکوبید تا قطرات اضافی خارج شوند) .
7) 100 میکرولیتر از محلول آنزیم کونژوگه آماده مصرف ً (روش آماده نمودن کونژوگه قبلا˝ گفته شده) را به کلیه چاهکها به استثناء چاهک بلانک اضافه نمایید .
8) پس از پوشاندن چاهکها توسط بر چسب مخصوص پلیت ، چاهکها را به مدت 30 دقیقه در37 درجه سانتی گراد انکوبه نمایید .
9) محتویات چاهکها را خالی کرده و چاهکها را 5 بار با محلول شستشوي آماده مصرف بشویید (همانند بند 6) .
10) 100 میکرولیتر محلول سوبسترا رنگزا به چاهک اضافه نمایید و بمدت 15 دقیقه در دماي اتاق و تاریکی انکوبه نمایید .
11) با اضافه کردن 100 میکرولیتر محلول متوقف کننده به هر چاهک، ادامه واکنشهاي آنزیمی را متوقف نمایید . براي سنجش جذب نوري هر چاهک از دستگاه
الایزاریدر با فیلتر nm450 استفاده نمایید و جذب نوري تمامی چاهکها را در مقابل بلانک قرائت نمایید (توصیه می شود از فیلتر nm630 بعنوان فیلتر رفرانس استفاده
شود) .
ارزشیابی آزمایش :
این آزمایش با داشتن شرایط زیر ارزشمند و قابل گزارش تلقی می گردد :
– جذب نوري کمتر از 0/1 براي بلانک، در صورت بیشتر بودن جذب نوري بلانک احتمالاً محلول رنگزا آلوده شده است .
– میانگین جذب نوري کمتر از 0/15 براي کنترل منفی، در صورت بیشتر بودن این جذب نوري احتمالاً شستشو به طور صحیح صورت نگرفته است ،
آزمایش را دوباره انجام داده و در مراحل شستشو دقت کنید .
– میانگین جذب نوري بیشتر از 0/8 براي کنترل مثبت ، در صورت کمتر بودن جذب نوري به تاریخ انقضاء کیت توجه نمایید .
محاسبه نتایج :
از هر دستگاه الایزاریدر با قابلیت سنجش جذب نوري در طول موج nm 450 می توان استفاده نمود .
1) جذب نوري کنترلها و نمونه ها را به کمک دستگاه الایزاریدر در طول موج nm450 و در صورت امکان در مقابل فیلتر رفرانس nm630 بخوانید .
2) جهت محاسبه off -Cut از فرمول زیر استفاده نمایید (جذب نوري بلانک را باید از جذب نوري همه نمونه ها و کنترلها کم نمود) .
+0/2 میانگین جذب نوري کنترلهاي منفی = value off-Cut
براي تعیین جوابهاي مثبت و منفی می توان از محاسبه اندکس Co/S نیز استفاده کرد .
جهت به دست آوردن اندکس Co/S از فرمول استفاده نمایید . مطابق این فرمول کلیه جوابها یی که Co/S آنها عدد 1 و یا بیشتر از یک باشد ،
مثبت و کلیه جوابهایی که Co/S آنها کمتر از 1 باشد، منفی تلقی میشوند .
بررسی نتایج :
– جواب منفی نشان دهنده عدم وجود آنتی بادي علیه آنتی ژنهاي HCV و یا غیر قابل سنجش بودن آنتی بادي (در مراحل اولیه عفونت) علیه آنتی ژنهاي HCV
می باشد .
– جوابهاي مثبت باید مجدداً˝ تکرار شوند. نمونه هاي مثبتی که در تکرار مجدد منفی میشوند ، باید منفی گزارش گردند. مثبت شدن آزمایش در مرتبه اول می تواند
در صورت مثبت شدن آزمایش در مرحله تکرار آن ، نمونه بایستی با روشهاي تاییدي وسترن بلات (blot Western (یا PCR مورد ارزیابی مجدد قرار گیرد
شاخصهاي اجرایی :
1) حساسیت : جهت بررسی حساسیت کیت ، پانلهاي BBI مورد ارزیابی قرار گرفت . این پانلها عبارتند از :
الف) Panels Seroconversion : نتایج آزمایش بر روي این پانلها بشرح ذیل میباشد :
BBI PHV 901 BBI PHV 914
BBI PHV 908 BBI PHV 907
BBI PHV 909
2) Panel) 301WWHV (Performance HCV Anti Wide World : این پانل حاوي20 نمونه بود که از این تعداد ، 18 نمونه از نظر HCV-Anti مثبت و
2 نمونه از نظرHCV-Anti منفی بودند که توسط این کیت نیز نتایج مشابهی بدست آمد .
Ortho 3.0
int.
S/Co
PT HCV
KIT
S/Co
Sample
ID
Ortho 3.0 int.
S/Co
PT HCV
KIT
S/Co
Sample
ID
1 5.8 >5.0 11 1.8 >5.0
2 5.9 >5.0 12 5.5 >5.0
3 5.8 >5.0 13 5.2 >5.0
4 5.8 >5.0 14 6 >5.0
5 0.1 0.0 15 3.9 >5.0
6 4 >5.0 16 3.9 >5.0
7 1.5 >5.0 17 2.5 >5.0
8 0.3 0.1 18 3.3 >5.0
9 3.8 >5.0 19 1.6 >5.0
10 5.4 >5.0 20 2 >5.0
همچنین تعداد 97 عدد نمونه مثبت، تایید شده توسط روش blot Western با کیت آزمایش شدند که همگی مثبت بودند .
با توجه به نتایج بدست آمده حساسیت کیت فوق جهت اندازه گیري آنتی بادي علیه HCV، 100 درصد و با کیتها و روشهاي تاییدي معتبر قابل مقایسه میباشد .
Ortho 3.0 int.
S/Co
PT HCV KIT
S/Co
2) اختصاصیت : جهت بررسی اختصاصیت کیت تعداد 2000 نمونه سرم و پلاسما بصورت Random با کیت فوق آزمایش شدند ، که از این تعداد 5 مورد مثبت
بودند . این 5 نمونه مجددا˝ با کیت تکرار شدند که از نتایج بدست آمده 3 مورد مثبت بودند و 2 نمونه در تکرار مجدد منفی شدند . بر اساس نتایج بدست آمده
اختصاصیت کیت در حدود -100 99/5 درصد (با حدود اطمینان 95 درصد) می باشد .
3) تداخلات : تعدادي نمونه سرم از نظر وجود آنتی بادیهاي HIV ، ANA و RF و همچنین بررسی شرایط همولیز و لیپمی با کیت آزمایش شدند که نتایج آن در
زیر آمده است .
۴) دقت آزمایش : جهت بررسی تکرار پذیري کیت ، آزمون هاي دقت درون سنجی (در یک کیت) و میان سنجی (بین چند کیت از یک سري ساخت) بوسیله
کنترل منفی و مثبت و یک نمونه سرمی مثبت انجام شد که نتایج آن در جداول زیر آمده است :
تعداد دفعات تکرار تست میانگین جذب نوري SD) % (CV – آزمون دقت میان سنجی (assay -Inter (:
کنترل مثبت 10 1/73 0/05 2/9
کنترل منفی 10 0/05 0/006 12
نمونه مثبت 10 0/31 0/01 3/2
تعداد دفعات تکرار تست میانگین جذب نوري SD) % (CV – آزمون دقت درون سنجی (assay -Intra ( :
کنترل مثبت 20 1/68 0/026 1/55
کنترل منفی 20 0/06 0/007 11/7
نمونه مثبت 20 0/31 0/014 4/52
*هر سري آزمایش ، به صورت دوپلیکیت انجام شده است .
References:
1.Guidelines for Laboratory Testing and Result Reporting of Antibody to Hepatitis C Virus: Centers for Disease Control and
Prevention .MMWR 2003; 52(No.RR-3).
2. Evaluation of a Rapid Assay as an Alternative to Conventional Enzyme Immunoassay for detection of Hepatitis C Virus- Specific Antibody. Journal of Clinical Microbiology2005; 43:1977-1978.
3. Are the Real HCV Infection Features in Iranian Patients the Same As What Is Expected? Hepatitis Monthly 2005; 5:3-5.
4. Significance of Indeterminate Third-Generation Hepatitis C Virus Recombinant Immunoblot Assay. Journal of Clinical
Microbiology 1996; 34:80-83.
5. Development of Simple and Highly Sensitive Enzyme Immunoassay for Hepatitis C Virus Core Antigen. Journal of Clinical
Microbiology 1999; 37:1802-1808.
6. Laboratory Assay for Diagnosis and Management of Hepatitis C Virus Infection. Journal of Clinical Microbiology2002;
40:4407-4412.
7. Low-Positive Anti-Hepatitis C Virus Enzyme Immunoassay Results: An Important Predictor of Low Likelihood of Hepatitis C
Infection. Clinical Chemistry 2003; 49:479-486.
8. Hepatitis C Virus in Iran: Epidemiology of an Emerging Infection. Arch. Iranian Med. 2005; 8:84-90.
9. Genetic Heterogeneity of Hepatitis Virus and its Clinical Significance. Current Drug Targets-Inflammation & Allergy 2005;
4:47-55.
نوع سرم آزمایش شده تعداد سرم آزمایش شده نتیجه بدست آمده
منفی 14 ANA Positive
منفی 31 Anti-HIV Positive
منفی 15 RF Positive
سرم همولیز 8 منفی
سرم لیپمیک 7 منفی
روش انجام آزمایش HCV – Anti بصورت شماتیک
چاهکهاي کوت شده با آنتی ژن اختصاصی HCV
کنترل ها – 200 میکرولیتر – محلول ها بلانک کنترل ها نمونه
محلول رقیق کننده نمونه – – 200 میکرولیتر
نمونه – – 10میکرولیتر
پلیت را به آرامی براي مدت 15 ثانیه تکان دهید تا محتویات چاهک ها به خوبی مخلوط شوند سپس دهانه چاهکها را با
برچسب مخصوص پلیت بپوشانید . 60 دقیقه در دماي 37 درجه سانتی گراد انکوبه کنید . برچسب پلیت را برداشته و
محتویات چاهکها را خالی کنید . طبق دستور شستشو 5 بار چاهکها را بشویید .
آنزیم کنژوگه – 100 میکرولیتر 100 میکرولیتر
دهانه چاهکها را با برچسب مخصوص پلیت بپوشانید . 30 دقیقه در دماي 37 درجه سانتی گراد انکوبه کنید . برچسب
پلیت را برداشته و محتویات چاهکها را خالی کنید. طبق دستور شستشو 5 بار چاهکها را بشویید .
محلول رنگزا 100 میکرولیتر 100 میکرولیتر 100 میکرولیتر
15 دقیقه در دماي اتاق و در تاریکی انکوبه کنید .
محلول متوقف کننده 100 میکرولیتر 100 میکرولیتر 100 میکرولیتر
جذب نوري چاهکها را در طول موج 450 نانومتر (در صورت امکان 630 نانومتر به عنوان فیلتر رفرانس) قرائت کنید .
قبل از محاسبه Cutoff ،OD بلانک را از تمامی OD ها کسر نمایید .
Sample
ID
1 0.5 0.0
2 0.3 0.0
3 4.9 5.9
4 3.8 6
5 4.4 6.1
6 3.9 6
7 5.8 >9.1
8 5.1 7.4
9 5.6 >9.1
10 4.9 9.1
11 5.3 >9.1
Ortho 3.0 FDA Li.
S/Co
PT HCV KIT
S/Co
Sample
ID
1 0.0 0.0
2 0.0 0.0
3 0.0 0.0
4 0.2 0.0
5 0.6 0.2
6 0.8 0.3
7 2.3 3.2
8 2.5 >4.7
9 3.1 >4.7
Ortho 3.0 FDA Li.
S/Co
PT HCV KIT
S/Co
Sample
ID
1 0.0 0.0
2 0.2 0.0
3 0.2 0.0
4 1.8 0.1
5 2.7 0.3
6 5.4 1.7
7 6.8 4.9
8 7.6 4.9
9 9.2 >5
10 9.8 >5
11 9.8 >5
12 10.9 >5
13 10.2 >5
Ortho 3.0 int.
S/Co
PT HCV KIT
S/Co
Sample
ID
1 0.3 0.0
2 0.2 0.0
3 0.2 0.0
4 1.3 0.1
5 3.3 0.4
6 3.2 1.0
7 3.7 4.4
Ortho 3.0
SAVe.
S/Co
PT HCV
KIT
S/Co
Sample
ID
1 0.2 0.0
2 1.2 1.3
3 1.1 1.3
درخواست محصول
.فقط مشتریانی که این محصول را خریداری کرده اند و وارد سیستم شده اند میتوانند برای این محصول دیدگاه(نظر) ارسال کنند.
محصولات پیشنهادی






نقد و بررسیها
هنوز بررسیای ثبت نشده است.